Pengertian Hukum Boyle Adalah – Hay sahabat sekalian.!Pada perjumpaan kali ini kembali akan quipper.co.id sampaikan materi tentang makalah Hukum Boyle.
Apa Itu Hukum Boyle?
Boyle adalah sebuah hukum yang ada dalam ilmu fisika dan menghubungkan besarnya tekanan dalam gas dengan volume gas.
Robert Boyle menemukan penelitian tentang hubungan antara tekanan dan volume suatu gas dalam ruang tertutup bila dikalikan hasilnya akan tetap atau konstan.
Menurut hasil penelitian yang dilakukan oleh penemu Boyle, bunyi hukumnya adalah sebagai berikut.
Daftar Isi :
Pengertian Hukum Boyle

Seperti yang sudah disampaikan diatas bahwa boyle merupakan sebuah hukum fisika yang menerangkan mengenai bagaimana adanya suatu hubungan antara tekanan dengan volume pada suatu gas.
Dimana pada mulanya hukum pertama kali ditemukan oleh salah seorang yang bernama Robet Boyle sekitar pada tahun (1627 sampai 1691).
Yang mana pada saat itu Robert melakukan suatu penelitian guna mencari tahu mengenai hubungan antara tekanan dengan volume gas pada suhu yang konstan.
Kemudian dari hasil penelitiannya tersebut, Robet Boyle memperoleh jawaban atas peneliiannya yang mana bahwa hasil kali tekanan dan volume gas yang ada didalam ruangan tertutup ia akan tetap atau konstan.
Dengan adanya pernyataan yangs sesuai dengan hasil penenmuannya maka hukum Robert Boyle ini disesbut dengan Hukum Boyle, yang memiliki bunyi:
“Pada suhu tetap, Adanya tekanan gas yang terjadi didalam suatu ruang tertutup akan berbanding terbalik dengan volumenya”
Rumus Hukum Boyle
Berdasarkan penjelasan diatas yang mana pada pernyataan tersebut diungkapkan mengenai hasil dari hukum boyl tersebut mempunyai makna yakni mengenai hasil dari kali tekanan dan juga volume gas yang berlangsung didalam suatu ruangan yang seluruh bagiannya tidak memiliki celah/ditutup rapat merupakan konstan (tetap) namun syaratnya suhu gas harus dalam keadaan tetap.
Berdasarkan Pernyataan diatas jadi apabila dituliskan ke dalam rumus, ialah:
P.V = C
Diman mana C ialah merupakan suatu bilangan bersifat tetap (konstanta). Apabila tekanan diubah maka volume pada gas tersebut akan berubah juga, jadi rumus diatas bisa ditulis seperti berikut:
P1 . V1 = P2 . V2
Keterangan :
P1 = Merupakan suatu tekanan gas mula-mula (atm.cm Hg, N/m2, Pa)
P2 = Merupakan suatu tekanan gas akhir (atm, cm Hg, N/m2, Pa)
V1 = Merupakan suatu volum gas mula-mula (m3, cm3)
V2 = Merupakan volum gas akhir (m3, cm3)
Namun perlu kalian ketahui bahwa Hukum boylee hanya dapat berlaku dalam keadaan:
- Suhu gas dalam kondisi tetap atau konstan
- Gas harus terdapat didalam sebuah ruangan yang tertutup
- Tidak mengandung suatu reaksi kimia
- Tidak terjadinya suatu perubahan wujud gas
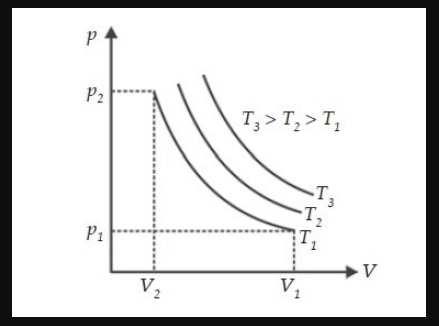
Grafik Hukum Boyle
Apabila digambarkan ke dalam sebuah grafik, maka hukumini akan membentuk menjadi sebuah kurva isoternal. Nah di bawah berupa Grafik Kurva isoternal.
Penerapan Hukum Boyle
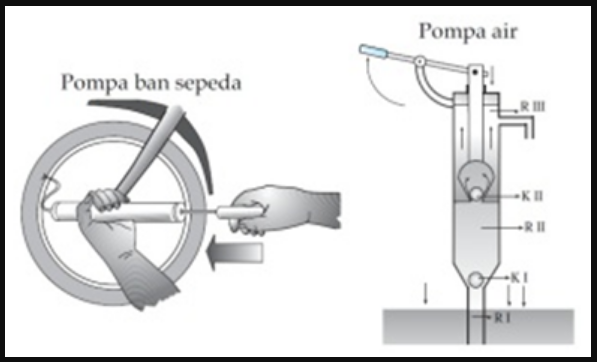
Kemudian menyinggung mengenai penerapan hukum boylle terdapat pada prinsip kerja pompa.
Dimana pompa ialah merupakan sebuah alat yang biasa digunakan untuk memindahkan gas/zat cair. Berdasarkan prinsip kerja ini, maka pompa dapat dikelompokkan atas dua yakni pompa hisap dan pompa tekan.
Pada saat penghisap ditarik, maka volume udara yang terdapat di dalam pompa tersebut akan semakin meningkat/membesar dan udara tidak bisa masuk ke dalam ban sebab harus masuk melalui katup (ventil) dari karet.
Apabila pengisap ditekan maka volume udara didalam sebuah pompa akan menjadi mengecil dan udara bisa masuk ke dalam ban dengan melalui ventil sebab tekanannya akan membesar.
Kemudian Alat sejenis yang menggunakn prinsip hukum boylee ialah seperti misalnya alat suntik, pipet, pompa tekan dan juga pompa hisap.
Percobaan Hukum Boyle
Hasil percobaan menunjukkan bahwa saat memompa atau menarik pompa, volume gas di ruang pompa akan semakin besar.
Jika suction atau pompa ditekan, maka volume udara di ruang pompa akan lebih sedikit dan udara dapat masuk ke dalam ban karena tekanan yang diberikan lebih besar.
Untuk melakukan percobaan Hukum Boyle pada umumnya memerlukan alat-alat sebagai berikut, yaitu: Alat lengkap Hukum Boyle Termometer dan barometer.
Nah, jika Anda sudah memahami Boyle dan bunyi hukumnya, serta contoh penerapan dan eksperimennya dalam kehidupan, ajukan pertanyaan praktis berikut ini.
Contoh Soal Hukum Boyle Dan Pembahasan
Nah berikut terdapat contoh soal dari hukum boylee ang dianatranya ialah sebagai berikut:
Contoh Soal 1
Contoh soal di bawah ini adalah tentang hukum Boyle, yaitu soal latihan untuk mencari nilai volume dan tekanan gas.
Tentang volume gas
Ada sebuah ruangan tertutup dengan volume 0,2 m3 dan berisi gas dengan tekanan 60.000 Pa. Berapa volume gas yang diisi dengan peningkatan tekanan pada 80.000 Pa?
Pembahasan Volume Gas
Diketahui :
- V1 = 0,2m3
- P1 = 60.000Pa
- P2 = 80.000Pa
Ditanya: V2….?
Jawaban: Menurut rumus hukum Boyle, maka P1 x V1 = P2 x V2.
- P_1\kali V_1=P_2\kali V_2\
- \ \
- \frac{P_1\times V_1}{P_2}=V_2\
- \ \
- \frac{60.000\times 0.2}{80.000}=V_2\
- \ \
- \frac{1,2}{8}=V_2\
- \ \
- 0,15m^3=V_2
- Jadi, ketika volume gas bertambah tekanannya, volume gas akan berkurang 0,15 m3.
Contoh Soal 2
Soal Tekanan Gas
Volume gas dalam ruang tertutup adalah 200 ml dan tekanan dalam ruang adalah 60 cmHg. Jadi, hitunglah tekanan gas yang volumenya 150 ml dalam ruang tertutup!
Bicara tentang tekanan gas
Diketahui :
- V1 = 200ml,
- P1 = 60 cmHg, dan
- V2 = 150ml
Ditanya: Q2….?
Jawab: Rumus mencari tekanan sama dengan rumus mencari volume gas.
- P_1\kali V_1=P_2\kali V_2\
- \ \
- \frac{P_1\times V_1}{V_2}=P_2\
- \ \
- \frac{200\times 60}{150}=P_2\
- \ \
- 80cmHg=P_2\
Hasilnya adalah 80 cmHg ketika volume gas dalam ruang adalah 150 ml.
Nah itulah yang bisa quipper.co.id sampaikan mengenai Hukum Boyle, semoga apa yang telah disampaiakan kali ini dapat bermanfaat bagi sahabat semua. Baca Juga : Konduktor dan Isolator
