Hukum – Hukum Tentang Gas – Hukum – hukum ini dikembangkan pada akhir abad ke 18.
Dan para ilmuwan mulai menyadari bahwa hubungan antara volume, suhu, dan tekanan dari sampel gas yang dapat diperoleh.
Menjadi dasar bagi pendekatan untuk semua gas dan gas berperilaku dengan cara yang sama.
Dalam berbagai kondisi karena semuanya mempunyai molekul yang sangat luas.
Dan pada persamaan keadaan untuk gas ideal ini berasal dari teori kinetik dan hukum gas pada sebelumnya.
Sekarang ini telah di anggap sebagai kasus terpilih persamaan dengan gas ideal dengan satu ataupun lebih dari variabel yang selalu dijaga kuat.
Nah pada pembahasan kali ini quipper.co.id akan membahas mengenai hukum – hukum gas, marilah kita simak pembasanya sebagai berikut ini.

Daftar Isi :
Macam – Macam Hukum Gas
Hukum Boyle
Dalam volume gas terdapat suatu ruang tertutup yang sangat bergantung pada tekanan dan juga suhunya apabila suhu tersebut dijaga secara konstan.
Maka tekanan yang diberikan itu akan memperkecilkan volumenya dan hubungan tersebut dikenal sebagai Hukum Boyle yang bisa dinyatakan sebagai berikut ini.
Apabila suhu gas yang berada didalam ruang tertutup tersebut dijaga secara konstan.
Maka pada tekanan gas tersebut akan berbanding terbalik dengan volumenya.
Konsepnya dapat diwakili dengan rumus sebagai berikut ini :

Yang mana P ialah tekanan, V ialah volume gas, dan k1 ialah konstanta dalam persamaan ini dan tidak sama dengan konstanta.
Persamaan 1 menyatakan bahwasannya pada suhu konstan apabila tekanan maupun volume gas tersebut berubah.
Maka variabel yang lain juga akan berubah sehingga hasil dari kali P.V selalu tetap.
Baca Juga : Sifat Zat Cair
Antara hubungan tekanan dan juga pada volume gas maka suhu konstan ini bisa dilukiskan dengan grafik seperti pada gambar dibawah ini :
Dibawah ini ialah merupakan gambar grafik pada hubungan P-V pada suhu konstan.
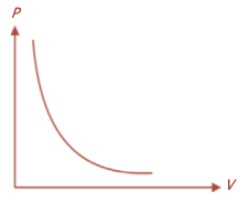
Grafik ini menunjukkan bahwa pada saat volumenya bertambah maka tekanan pada gas akan berkurang.
Maka proses pada suhu tersebut akan konstan dapat disebut dengan proses isotermis.
Hukum Charles
Diketahui bahwa selain dapat ditentukan oleh tekanan maka volume gas dalam ruang tertutup dapat dipengaruhi oleh suhu.
Apabila suhu gas tersebut di naikkan maka pada gerak partikel – partikel gas tersebut akan semakin cepat sehingga volumenya akan semakin bertambah pula.
Jika tekanan tidak terlalu tinggi dan dijaga dengan konstan maka volume pada gas akan bertambah.
Dengan kenaikan suhu dan hubungan tersebut dikenal sebagai Hukum Charles yang dapat dinyatakan sebagai berikut ini.
“Jika tekanan pada gas berada dalam ruangan tertutup dan dijaga secara konstan”.
Maka volume pada gas tersebut dapat berbanding lurus dengan suhu mutlaknya.
Dengan cara matematis pernyataan ini dapat dituliskan sebagai berikut :

Penjelasannya :

Hubungan antara volume gas dan juga pada suhu maka tekanan pada konstan dapat dilukiskan dengan grafik pada gambar dibawah ini :
Dibawah ini ialah merupakan gambar grafik hubungan V-T pada tekanan konstan.
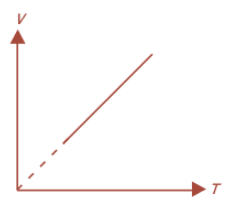
Grafik ini menunjukkan bahwa proses yang terjadi pada tekanan dapat disebut dengan proses isobaris.
Hukum Gay Lussac
Jika botol dalam keadaan tertutup terus kita masukkan kedalam api maka botol tersebut akan meledak.
Hal ini terjadi karena naiknya suatu tekanan gas yang ada didalamnya karena kenaikan suhu.
Dengan demikian itu hal ini dapat dikatakan bahwa : “Jika volume gas yang berada pada ruang tertutup tersebut dijaga konstan”.
Maka tekanan pada gas tersebut bisa berbanding lurus dengan suhu mutlaknya.
Pernyataan ini dikenal sebagai Hukum Gay Lussac, dengan cara matematis hal ini dapat dituliskan sebagai berikut :
P ∞ T
P/T = Konstan atau P1/T1 = P2/T2.
Penjelasannya :
P1 = Tekanan pada gas keadaannya satu (N/m 2)
T1 = Suhu mutlak pada gas keadaannya 1(K)
P2 = Tekanan pada gas keadaannya 2 (N/m 2)
T2 = Suhu mutlak pada gas keadaannya 2(K)
Hubungan antara tekanan dan juga pada suhu gas dan volume konstan ini bisa dilukiskan dengan cara grafik pada gambar dibawah ini :
Dibawah ini ialah merupakan gambar grafik hubungan P-T pada volume konstan.
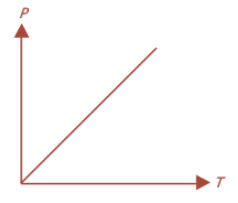
Grafik ini menunjukkan bahwa proses yang terjadi pada volume konstan disebut dengan proses isokhoris.
Hukum Boyle-Gay Lussac
Hukum ini merupakan gabungan dari persamaan 1, 2, dan juga 3, sehingga hal ini dapat dituliskan dengan :
PV/T = Konstan
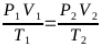
Persamaan Umum Hukum Gas Ideal
Sebelum kita lanjut membahas tentang persamaan umum gas ideal kita akan mendefinisikan beberapa istilah kimia yang berkaitan dengan gas ideal yaitu sebagai berikut.
Massa Atom Relatif (Ar)
Ini ialah merupakan suatu perbandingan massa rata – rata pada sebuah atom dan pada suatu unsur terhadap 1/12 kali massa pada suatu atom 126C .
Dan harga massa atom relatif itu bukanlah massa yang sebenarnya dari suatu atom tersebut.
Akan tetapi itu hanyalah merupakan suatu harga dalam perbandingan itu saja.
Contohnya yaitu :
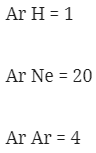
Massa Molekul Relatif (Mr)
Hal ini ialah merupakan jumlah dari keseluruhan massa atom relatif (Ar) untuk unsur – unsur penyusun senyawa.
Mol (N)
Mol (n) ini ialah merupakan satuan dari banyaknya partikel yang besarnya merupakan hasil bagi massa pada suatu unsur senyawa dengan massa relatifnya yaitu Ar atau Mr.
Bilangan Avogadro
Hukum avogadro ini menyatakan bahwa untuk tekanan, volume, dan juga suhu yang konstan semua gas ini mengandung jumlah molekul yang sama.
(1 mol pada gas STP dapat mengisi volume 22,4 L) hal ini berguna untuk memastikan hubungan di antara jumlah pada gas (X) dan juga volume pada gas (V).
Kita perlu mengetahui bukti dari teori kinetik gas yaitu sebagai berikut :
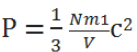
Sekarang sebagai C2 ∝ T jadi pada konstanta (V, P, & T, N) = Konstanta untuk massa gas yang tertentu.
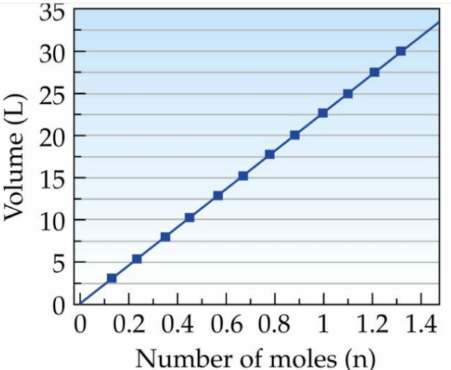
Apabila jumlah molekul gas meningkat maka volume pada gas juga akan meningkat.
Apabila suhu dan juga tekanan tetap maka fraksi jumlah pada volume akan konstan :
v1/n1 = v2/n2 = v3/n3 dst …
Contohnya : Ketika kita menghirup udara maka paru – paru akan mengembang.
Begitu juga pada volume paru – paru ketika kita menurunkan atau mengeluarkan napas.
Hukum – Hukum Tentang Gas Ideal Dan Gabungan
Hukum Gas Gabungan
Hukum ini ialah merupakan suatu hukum gas yang dapat menggabungkan dari hukum Boyle, Charles, hukum Gay Lussac, dan hukum Boyle-Gay Lussac.
Hukum ini tidak ada pendiri resminya dan hukum ini hanyalah sebuah penggabungan dari empat hukum yang sebelumnya telah ditemukan.
Masing – masing hukum ini saling menghubungkan dari satu variabel termodinamika ke variabel matematis lainnya sementara itu menjaga variabel yang lain tetap konstan.
Hukum Boyle menegaskan bahwasannya tekanan dan juga volume berbanding terbalik satu sama lain pada suhu yang tetap.
Hukum Charles mengatakan bahwa volume dan juga suhu berbanding lurus satu sama lain, selama tekanan tersebut tetap konstan.
Nah sekarang kita dapat dengan mudah untuk menggabungkan hukum Boyle, Charles.
Dan juga hukum Guy Lussac menjadi persamaan hukum gas gabungan atau persamaan dari gas umum.
Baca Juga : Alat Ukur Waktu
Dengan hal ini kita dapat menentukan hubungan antara volume, suhu, dan juga tekanan untuk kuantitas tertentu pada hukum gas gabungan.
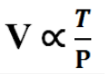
Volume gas yang diberikan tersebut berbanding lurus dengan suhu kelvin dan juga berbanding terbalik pada tekanan.
PV/T = Konstan
Volume dan juga suhu awal dan akhirnya pun dapat dihitung :
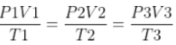
Hukum Gas Ideal
Hukum gas ideal ini dapat diperoleh dengan menambahkan hukum avogadro kepada hukum gas gabungan yaitu :
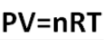
Yang mana :
- T : Suhu (K) formulasi lain dari hukum gas ideal yang dapat dituliskan.
- R : Konstanta gas universal, yaitu 8,3144598 (kPa ∙ L) / (mol ∙ K).
- N : Jumlah mol.
- V : Volume.
- P : Tekanan.
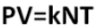
Yang mana :
- K : Konstanta Boltzmann, 1,381 × 10−23 J · K − 1 dalam satuan SI.
- N : Jumlah molekul gas.
- T : Suhu (K).
- P : Tekanan.
- V : Volume.
Nah itulah yang dapat quipper.co.id bahas kali ini mengenai Hukum – Hukum Tentang Gas.
Semoga pembahasan ini dapat menambahkan wawasan dan juga bermanfaat bagi anda.
Artikel terkait lainnya :
